發布日期:2025-8-10 9:02:40
引言
人體內常發生骨相關的退化或惡化現象,如股骨頭壞死、關節損傷、牙齒的磨損和腐蝕等,不僅使患者遭受疼痛,而且組織和器官可能出現部分或完全的功能性喪失 [1]。尤其是隨著人口老齡化程度的加深,相關疾病所累及的人口持續增加,對生物醫用材料的需求不斷提高,生物醫用金屬材料、陶瓷材料、高分子材料等得到廣泛的關注與應用。其中金屬及合金由于具有高強度、高韌性和優良的抗疲勞性能,廣泛應用于人體硬組織、軟組織、人工器官和外科輔助器材等各個方面,是醫用植入物和設備必不可少的材料。圖 1 是由金屬及合金材料通過復雜的加工工藝制造出的各類植入物產品,如心血管支架、接骨板、接骨螺釘、人工關節、牙種植體、脊柱內固定植入物等,其在臨床上的應用量在 40% 以上,是臨床應用最廣泛的承力型植入材料 [2]。
骨科植入物常用金屬材料主要有醫用不銹鋼、鈷基合金、鈦及其合金三大類。較早實現臨床應用的醫用不銹鋼(316L)和鈷基合金(如 Co-Cr-Mo 合金)由于含有 Ni、Co、Cr 等元素,存在致敏、致畸、致癌等潛在危害 [3],還存在耐腐蝕性能差、彈性模量高、無生物活性等問題,在臨床上逐漸被 Ti 合金取代。鈦及鈦合金密度小,比強度高,彈性模量較低,生物相容性和耐腐蝕性能都優于不銹鋼和鈷基合金。自 20 世紀 40 年代被引入到生物醫學領域以來,Ti 及其合金得到快速發展并實現商業化,商業純鈦(cp-Ti)和 Ti-6Al-4V(質量分數,%,如無特別說明,下同)是典型代表 [4]。但有研究發現,cp-Ti 的強度較低,使得小直徑螺釘(≤3.5mm)斷裂的概率大大增加,限制了其在高應力作用下的應用 [5]。而且 Ti 合金硬度較低,耐磨性差,磨損的顆粒腐蝕產物會進入生物組織,引起植入物失效。大量的臨床實驗與數據證明,Ti-6Al-4V 合金中的 Al 和 V 都會導致長期的健康問題,在人體組織中引起不良反應 [6-7]。此外,cp-Ti 和 Ti-6Al-4V 的彈性模量分別約為 105GPa 和 110GPa,盡管相對于 316L 不銹鋼(210GPa)和 Co-Cr-Mo 合金(240GPa)有大幅度降低,但是仍然顯著高于人體皮質骨的彈性模量(10-30GPa),這會造成金屬植入物和周圍骨骼之間的應力遮擋效應 [8-9],從而導致骨吸收或骨萎縮,引起植入物松動或斷裂,對人體造成二次傷害。隨著中、青年創傷的增加,人們對植入物材料的性能和使用年限有了更高的要求,鈦及鈦合金的問題愈加突出,也推動著研究人員開發性能更優異的新型 Ti 基合金或其他新型生物醫用金屬材料,以取代 Ti-6Al-4V 合金。
鋯(Zr)是一種無毒金屬,具有良好的耐腐蝕性能、生物相容性和力學性能。因為 Zr 和 Ti 在元素周期表中屬于同一主族,具有相似的物理和化學性質,所以常被用作合金化元素添加至 Ti 合金中以提高力學性能。據報道,在元素周期表中的金屬,只有 Zr 和 Ti 支持成骨細胞生長和骨整合。與 Ti 及其合金相比,Zr 合金具有高強度、高斷裂韌性和低彈性模量;具有更低的磁化率 [11],能顯著降低偽影,幾乎不會對磁共振成像(MRI)造成干擾;Zr 還具有比 Ti 更高的骨接觸程度,具有低離子釋放、低細胞毒性和良好的骨整合能力 [12]。目前,Zr 及其合金作為創傷科、骨科和牙科植入物材料在醫學領域受到青睞,尤其是表面氧化的 Zr-2.5Nb 合金(Oxinium)因優異的耐磨性已被成功商用于人工膝關節和髖關節 [13]。此外,Zr 在暴露于空氣或水溶液中時容易自發形成致密的氧化膜(ZrO₂),這層氧化膜不僅能夠降低腐蝕速率,抑制金屬離子釋放,而且決定了其生物相容性和骨整合程度。Zr 合金表面這種氧化層的生物惰性和不可吸收特性使 Zr 及其合金成為骨科植入物的理想候選材料。為了賦予合金以生物活性,人們也陸續開發了幾種新的表面改性技術修飾 Zr 合金表面,如微弧氧化、等離子噴涂、堿性處理、溶膠 - 凝膠法等,以提高合金的骨整合能力。表面改性技術的應用促進了 Zr 合金植入物與骨骼的良好融合,是將生物醫用 Zr 合金推向臨床應用的重要環節。
Zr 基合金是最有前途的現代生物醫用材料之一,具有取代 Ti 及其合金成為新一代生物醫用金屬材料的巨大潛力。基于 Zr 基合金的優良性能與發展前景,本文將歸納目前醫用 Zr 合金研究的主要合金體系,對合金的基本性能與表面改性技術進行總結,并對醫用 Zr 合金的未來發展方向進行展望,為后續骨科植入物材料的發展提供有價值的參考。
1、醫用鋯合金體系
Zr 有兩種晶格結構,室溫下為密排六方(hcp)結構,稱為 α-Zr,α-Zr 在約 863℃時發生同素異構轉變,轉變為體心立方(bcc)結構,稱為 β-Zr。Zr 合金在生物醫學領域的研究可追溯至 20 世紀 90 年代,Zr 因其耐腐蝕性能優良且是無毒金屬,常被用作 Ti 的合金化元素。研究表明,Ti-Zr 合金硬度和拉伸強度均隨 Zr 含量的增加而提高,且比純 Ti 和 Ti-6Al-4V 合金具有更高的硬度、拉伸強度和更接近人骨的彈性模量 [16],在生物環境中具有良好的耐腐蝕性和穩定性 [17],作為牙科種植體材料在臨床中具有高種植成功率(95.2%~100%)[18-21],表現出良好的骨融合與可接受的骨水平變化。Ti-Zr 合金的成功種植促進了醫用 Zr 合金的研發,通過添加一些無毒的金屬元素,如 Nb、Mo、Sn、Ti、Cu、Si、Ta 等,得到性能優異的 Zr 合金。Guglielmoti 等 [22] 使用酸洗后的純 Zr 與純 Ti 植入物植入維斯塔爾(Wistar)大鼠體內并保持 30d,結果表明 Zr 與大鼠脛骨能發生更良好的界面反應,說明 Zr 具有更良好的骨相容性,其腐蝕產物的毒副作用也更低。Tsutsumi 等 [23] 研究發現,Zr 不會與鈣發生反應形成磷酸鈣(人骨的主要成分),而是形成高度穩定且具有保護作用的磷酸鋯,Zr 的這種特性可以避免與骨骼同化,進而避免骨折發生。
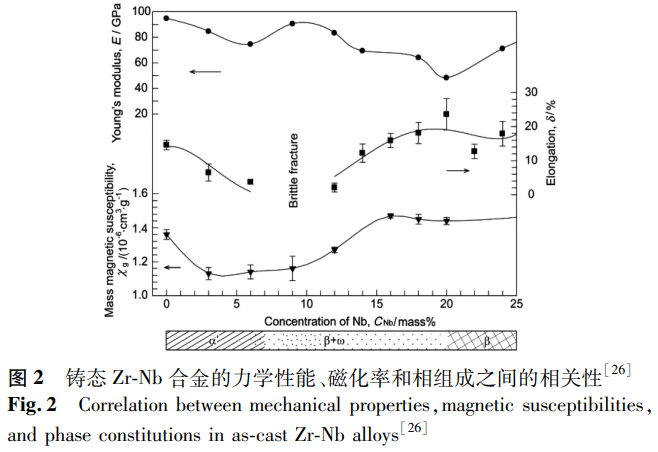
通過調節添加元素的種類和含量可以提高 Zr 合金的力學性能、耐腐蝕性能等。從目前對醫用 Zr 合金的研究與探索來看,醫用 Zr 合金主要可分為三大系列:Zr-Nb 系、Zr-Mo 系及 Zr-Ti 系合金。Nb 是 Zr 合金的有效強化元素,也是 β-Zr 穩定元素。2009 年,Branzi 等 [24] 研究了 Zr-xNb(x=0,2.5,10)合金的電化學行為和表面硬度,發現其耐腐蝕性能和表面硬度均隨 Nb 含量增加而提高,從而使該合金在人體關節置換術中的應用成為可能。同時期,Nomura 等 [25] 研究了 Zr-xNb(x=0~40)合金相組成對其磁化率的影響,發現隨著 Nb 含量的增加,相組成會發生 α'→α'+β+ω→β+ω→β 的轉變,ω 相的存在會顯著降低合金的磁化率,鑄態 Zr-3Nb 合金的磁化率幾乎是 Ti-6Al-4V 合金的 1/3。在此基礎上,Kondo 等 [26] 進一步研究了鑄態 Zr-Nb 合金中相組成對其力學性能與磁化率的影響,結果如圖 2 所示。研究表明,由 α 或 β 相組成的 Zr-Nb 合金具有優異的力學性能和較低的磁化率,可用于磁共振成像下的醫療設備,而 ω 相的存在雖然使磁化率降低,但也使合金變得易碎,延展性和韌性降低。因此,當需要低磁化率和高楊氏模量時(例如動脈瘤夾),由 α 相組成的 Zr-Nb 合金較為適用;當需要低磁化率、低楊氏模量和大伸長率時(例如髖關節假體、骨板和螺釘),主要由 β 相和少量 ω 相組成的 Zr-Nb 合金較為適用。為了評估 Zr-Nb 合金的生物醫學應用,Zhou 等 [27] 對退火態 Zr-xNb(x=0,2.5,16,22)合金的顯微組織、腐蝕行為和細胞毒性進行了研究,發現隨著 Nb 含量的增加,合金的耐腐蝕性能提高,Zr-22Nb 合金具有最佳的電化學性能和良好的生物相容性。基于 ω 相的低磁化率特性,Kondo 等 [28] 通過冷軋 Zr-14Nb 證實了 ω 相可由應變誘導形成,且 ω 相的形成降低了 Zr-14Nb 的磁化率,其磁化率約為 Ti 合金的 1/3。Zhao 等 [29] 也通過形變誘導 ω 相變和冷軋,得到了具有低磁化率、楊氏模量可調的 Zr-17Nb 合金,其可以作為脊柱固定桿的潛在應用材料。
在 Zr-Nb 二元合金體系的基礎上,研究人員通過添加合金元素 Ti、Ta、Mo、Sn 等開發了三元醫用 Zr 合金。Nie 等 [30] 制備了鑄態 Zr-20Nb-xTi(x=0,3,7,11,15,原子分數,%)合金,該合金力學性能較 Zr-Nb 二元體系有所改善,擁有更高的彈性能,這意味著添加 Ti 可以使合金承受更大的彈性變形。Xue 等 [31] 研究了由 α'+β 相組成的鑄態 Zr-16Nb-xTi(x=0,4,8,12,16)合金,結果表明 Zr-16Nb-4Ti 合金具有良好的生物相容性和耐腐蝕性能,實現了低彈性模量(50GPa)和低磁化率的性能組合。王明康等 [32] 研究了 Ti 對 Zr-Nb 系二元合金 β 結構穩定性和力學性能的影響,發現添加適量的 Ti 會顯著抑制 ω 相的析出,提高 β 結構的穩定性,但過量 Ti 替代 Nb 時會降低 β 相的穩定性。綜合來看,Zr-Nb-Ti 合金作為一種骨科植入物材料具有較高的研究價值與應用潛力。Rosalbino 等 [33] 研究了 Zr-Nb-Ta 三元合金的體外耐腐蝕性能和生物相容性,認為該三元合金作為外科植入物具有良好的應用前景。Liang 等 [34] 采用基于 CALPHAD 的建模方法對 Zr-Nb-Mo 三元合金的成分進行篩選,同時對合金整體及其〈100〉方向的楊氏模量進行預測,結果顯示〈100〉方向的楊氏模量更小,該研究利用計算方法開辟了一種開發生物醫用材料的新途徑。
Mo 具有低磁化率(χ_Ho=0.75×10⁻⁶cm³/g)、低細胞毒性,是 Zr 的有效強化元素。Suyalatu 等 [35] 對鑄態 Zr-Mo 合金的磁化率和力學性能與微觀結構之間的關系進行研究,結果顯示 Zr-1Mo 合金以針狀的 α 相為主,Zr-3Mo 合金以 β 相和 ω 相為主,Mo 含量超過 10% 的合金中只有 β 相存在;鑄態 Zr-Mo 合金的磁化率隨 Mo 含量的增加呈先降低后升高的趨勢,Zr-3Mo 合金由于 ω 相的存在,磁化率最低,但也發生了脆性斷裂,在經過時效處理后 Zr-3Mo 合金的相組成轉變為 α+β 相,強度和延伸率顯著提高 [36]。Zhou 等 [37] 研究發現 Zr-xMo(x=0,1,3,5,10)合金均具有優異的耐腐蝕性能和生物相容性,表面由 Zr 和 Mo 氧化物形成的混合鈍化膜比單一的 ZrO₂鈍化膜更穩定;以 α 相為主的 Zr-1Mo 合金表現出更高的硬度、彎曲強度和模量,意味著更高的塑性變形與耐磨性,由 β 相組成的 Zr-10Mo 合金雖然強度略低,但具有更接近人骨的彈性模量。Nie 等 [38] 將 Ti 元素引入 Zr-Mo 合金中,制備了鑄態 Zr-12Mo-xTi(x=0,3,7,11)合金,所有合金均為 β 相,隨著 Ti 含量增加,合金的晶粒變小,組織細化,具有優異的屈服強度(1175-1375MPa)和合適的楊氏模量(32-35GPa),彈性能(20-28MJ/m³)顯著高于大多數 Ti 基合金(1-5MJ/m³),具有很好的生物應用潛力。Guo 等 [39] 設計并制備了一種低成本的新型亞穩態 β 型 Zr-4Mo-4Sn 合金,采用原位 XRD 技術和 Eshelby-Kroner-Kneer 彈塑性自治模型,從 β 型 Zr-4Mo-4Sn 多晶中提取了單晶彈性常數(C₁₁,C₁₂,C₄₄),發現合金在 {110}<110 > 和 {001}<100 > 取向的剪切下具有較低的 β 相穩定性,這導致了 Zr-4Mo-4Sn 合金的低楊氏模量,為設計和開發具有超低楊氏模量和低磁化率的新型 β 型 Zr 合金提供了一些新思路。
Zr-Ti 合金因具有熔點低、磁化率低、線膨脹系數低等優點,在牙科等硬組織替代物材料中受到青睞。2009 年,Hsu 等 [40] 對 Zr-xTi(x=0~40)合金的晶體結構和力學性能進行研究,發現添加 10% Ti 可以使 Zr 合金抗彎強度與彈性模量的比值提高 70%。Wei 等 [41] 制備了牙科植入用的新型 Zr-25Ti-xMo(x=0~12.5)合金,發現隨著 Mo 含量的增加,合金的相組成發生 α 相→α+β 相→β 相的轉變,楊氏模量為 17.7-24.4GPa,與人骨相適配,其中 Zr-25Ti-7.5Mo 合金表現出最佳的耐磨與耐腐蝕性能,是極具潛力的牙科植入物材料。Wang 等 [42] 研究了 Nb 元素對 Zr-Ti 基生物材料力學性能和耐腐蝕性能的影響,發現合金均由 β 相和 α'' 相組成,Nb 元素的添加提高了合金中 β 相的穩定性,應力誘發馬氏體相變極大地提高了材料的抗拉強度和塑性,且材料在生理鹽水中表現出較強的耐腐蝕性能。
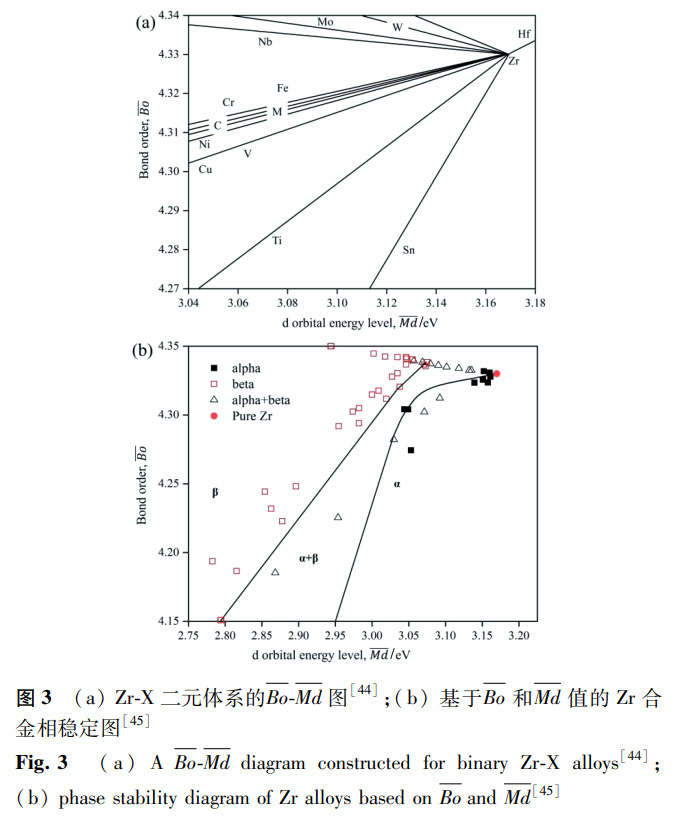
除 Zr-Nb、Zr-Mo 和 Zr-Ti 系合金外,其他合金(如 Zr-Hf、Zr-Cu、Zr-Sn 等)也有研究,但整體而言,生物醫用 Zr 合金的研究還是較少,新型的合金成分設計、多組元化是研究的重要方向。在合金設計上,Mo 當量公式、d 電子理論、價電子濃度等理論常用于指導 Ti 合金的成分設計,同樣也可以用于設計 Zr 基金屬植入物,但這些理論的完善仍需要大量實驗數據的支撐。其中,d 電子理論采用 Bo(金屬元素間的結合次數)和 Md(合金元素的 d 軌道能)兩個參數來控制合金的相穩定性和性能,且經實驗驗證取得了理想的性能預測與成分優化效果,被證明是設計新型醫用 Ti 合金的有效方法 [43]。針對 Zr 合金,Shibutami [44] 繪制了 Zr-X 二元體系合金的 Bo-Md 圖,以了解各元素合金化對 Bo 和 Md 值的影響,如圖 3a 所示;在此基礎上,Afrin 等 [45] 計算了一系列 Zr 合金的 Bo-Md 值,分析了 Zr 合金相變、性能和 Bo-Md 的關系,如圖 3b 所示。對于成分已知的 Zr 合金,計算合金的 Bo 和 Md 值,在圖上找到相應的位置,可以初步預測所設計合金的性能是否滿足生物醫用材料的要求。Bo-Md 圖可以協助低模量 Zr 基合金的設計,但仍需要更多的實驗結果與計算來確定詳細的相穩定臨界條件,為合金設計提供準確的理論依據。
2、醫用鋯合金的性能要求與研究現狀
2.1 力學性能
醫用金屬材料通常作為受力器件在人體內 “服役”,應用為人工關節、骨板骨釘、牙種植體、人工椎體等,因此其力學性能是需要重點關注的對象之一。人體部分骨骼的受力狀態是相當惡劣的,如人工髖關節在行走過程中(下肢偏轉)作用在髖關節上的力是體重的數倍 [46],若要使其使用壽命保持在 15 年以上,則材料必須具有優良的力學性能和耐磨性。人骨的強度并不是很高,如股骨頭的抗壓強度僅為 143MPa,縱向彈性模量約為 13.8GPa,徑向彈性模量為縱向的 1/3,但其斷裂韌性較高。為防止材料在沖擊載荷下發生斷裂,通常要求材料的強度高于人骨的 3 倍。目前商用的金屬植入物的彈性模量均遠高于人骨,這會誘發應力遮擋效應 [47],引起人體骨吸收并導致種植體松動,因此植入物金屬材料的彈性模量應當與人骨接近。在長期臨床經驗基礎上,人工髖關節的醫用金屬材料應滿足的基本力學性能要求 [48]:屈服強度不低于 450MPa,極限抗拉強度不低于 800MPa,疲勞極限高于 400MPa,彈性模量不超過人骨(10-30GPa),伸長率高于 8%。因此,在進行生物醫用金屬材料的成分與結構設計過程中,需要充分考慮人體骨骼的性能,設計出與其相匹配的材料。
Zr 基合金的力學性能在很大程度上取決于其化學成分和相結構 [26]。Zhou 等 [14] 系統研究了含不同合金元素的 Zr-1X 合金的顯微組織、力學性能和磁化率,如圖 4 所示。
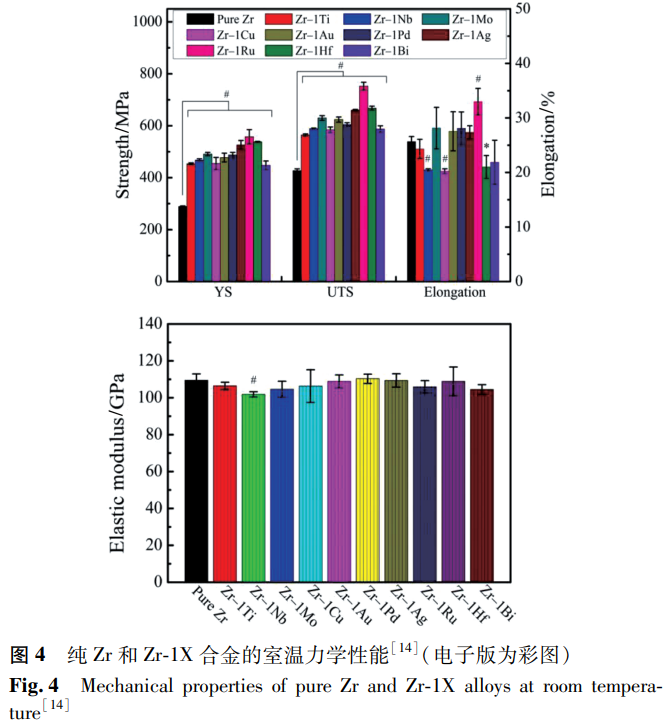
合金均由 α 相組成,合金化顯著提高了純 Zr 的強度和硬度,這些具有高楊氏模量和低磁化率的 α 相 Zr 合金是 MRI 環境下醫療器械的良好候選合金。表 1 總結了目前研究的一些醫用 Zr 合金材料的力學性能數據。由表 1 可知,鑄態純 Zr 的強度較低,屈服強度(YS)為 207-304MPa,極限抗拉強度(UTS)為 379-440MPa,楊氏模量為 88-95GPa,這與 Zr 中雜質的含量不同有關。添加 Nb 可明顯提高 Zr 的強度,其強化作用與 Nb 含量和相組成密切相關。有研究發現 β 型 Zr-Nb 合金具有良好的力學性能,Zr-(3-24)Nb 合金的 YS 在 559-750MPa,UTS 在 605-881MPa,彈性模量最低降至 48.4GPa。Ti 和 Mo 的添加也可以提高合金的強度,鑄態 Zr-20Nb 合金的 YS 為 857MPa,UTS 為 1046MPa,添加 15% Ti 后,YS 和 UTS 分別增加到 1071MPa 和 1307MPa [30],在純 Zr 中加入 1% Mo 可得到 970MPa 的 UTS [36],但其斷裂韌性較差。總體來看,由 β 相組成的 Zr 合金更適用于需要高強度、低彈性模量和較大延伸率的情況,也是目前醫用 Zr 合金研究的主要方向。
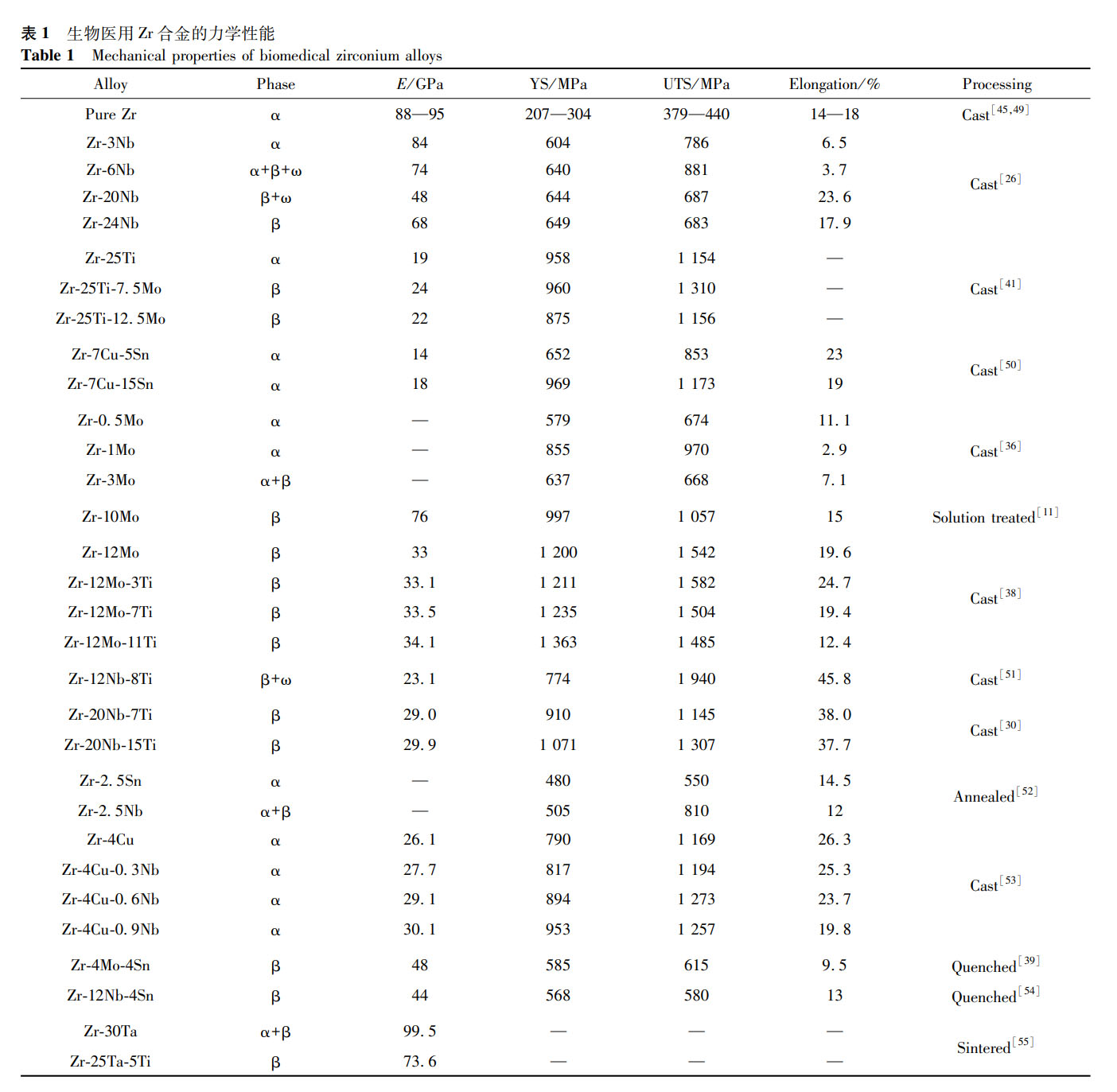
2.2 耐腐蝕性能
人體是一個嚴苛的腐蝕環境,體液中存在 Na⁺、Cl⁻和 HCO₃⁻等以及各種復雜的有機化合物,如蛋白質、酶、糖類等,金屬材料植入體內后需持久地浸泡于其中,被化學侵蝕在所難免 [3]。而且人體內不同部位的 pH 值也不盡相同,體內組織在受傷或感染時 pH 值也會發生變化。例如正常情況下體液的 pH 值為 7.4,受傷時可能低至 3.5,感染時有可能升高至 9.0 [56],這使得金屬植入物在體內不同 pH 條件下顯示出不同的耐腐蝕性。腐蝕不僅破壞金屬材料的力學性能,導致其斷裂,還可能產生對人體有刺激性和毒性的腐蝕產物,因此優異的耐腐蝕性能對金屬植入物來說至關重要。醫用金屬材料在生理環境中的腐蝕機制十分復雜,材料與人體之間相互影響、互為因果,而且腐蝕有時會同時出現幾種類型,這對醫用金屬材料的腐蝕實驗研究和測試技術也提出了更高的要求。
純 Zr 在各種水溶液和酸中具有優異的耐腐蝕性能,由于對氧的高親和力,Zr 基合金表面會自發形成氧化層,這進一步提高了它們的耐腐蝕性能。表 2 總結了目前研究的一些醫用 Zr 合金材料的耐腐蝕性能數據。從表 2 可以看出:(1)通過合金化整體降低了腐蝕電流密度,提高了純 Zr 的耐腐蝕性能,其中元素 Ti、Nb、Ta 對增強 Zr 抗點蝕能力的效果顯著;(2)電解質對 Zr 及其合金表面氧化膜的生長和穩定性有較大影響,它們的耐腐蝕性能隨著 Cl⁻的存在而惡化,即隨著 Cl⁻向氧化膜內的遷移,鈍化膜容易受到侵蝕,形成點蝕;(3)在多種實驗環境中 Nb 元素的添加都改善了 Zr 合金的耐腐蝕性能,這歸功于表面生成了更加致密且穩定的鈮氧化物;(4)目前的研究中,氧化處理后的 Zr-3Sn、Zr-20Nb-3Ti 等合金腐蝕電流密度均明顯低于未氧化 Zr 合金,同等實驗條件下未發生擊穿現象,說明預氧化 Zr 合金具有較為優異的耐腐蝕性能。
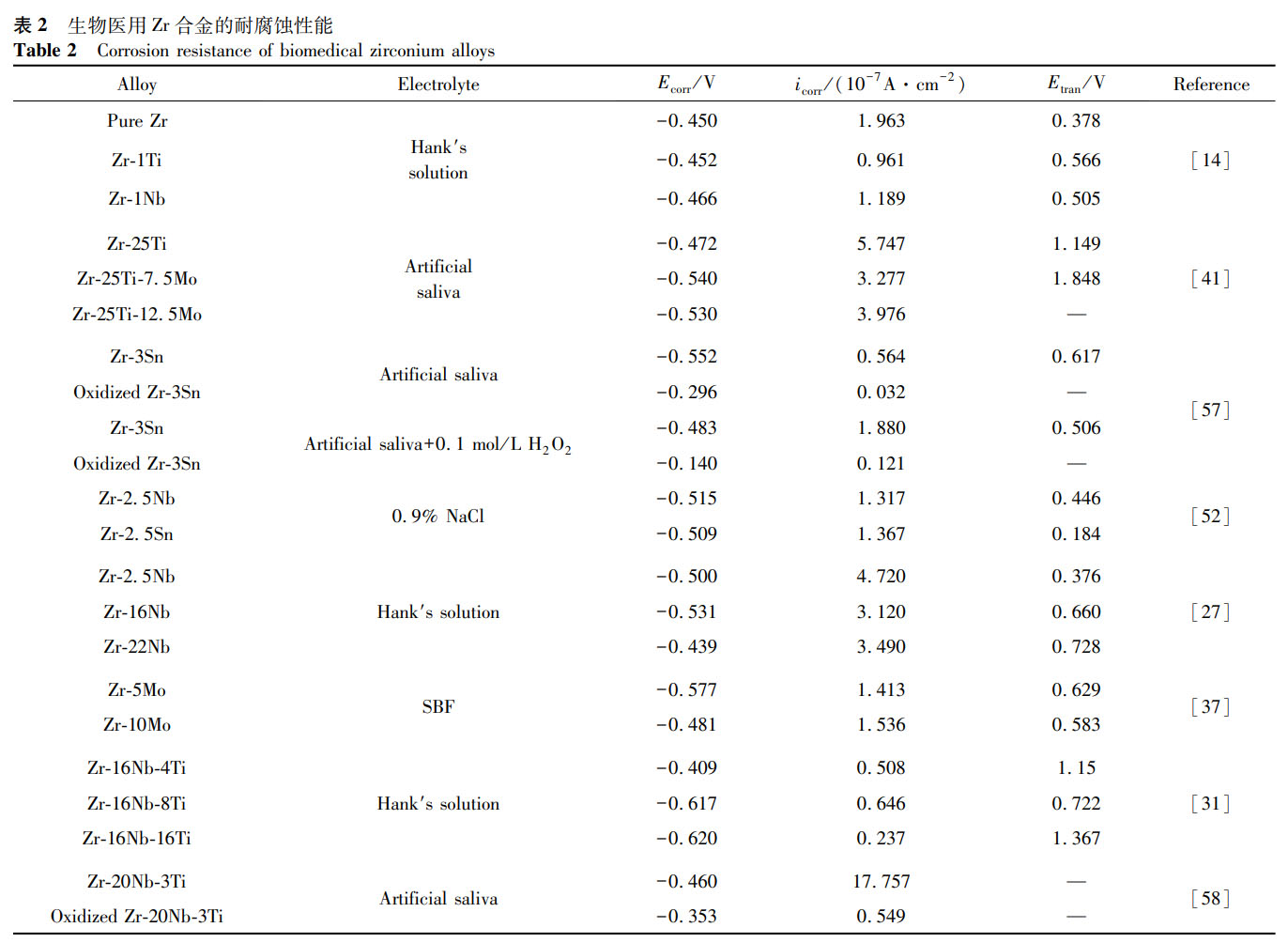
2.3 生物相容性
良好的生物相容性是骨科植入物材料的基本要求,理想的骨科植入物應該在預期的使用周期內既不會引起宿主機體明顯的臨床反應,也具有良好的物理和化學穩定性。良好的生物相容性具體表現在:對人體無毒、無刺激、無致癌、無突變等有害作用;對人體無排異反應;與周圍的骨骼及組織能夠形成化學鍵合,具有生物活性;無溶血、凝血反應 [59]。
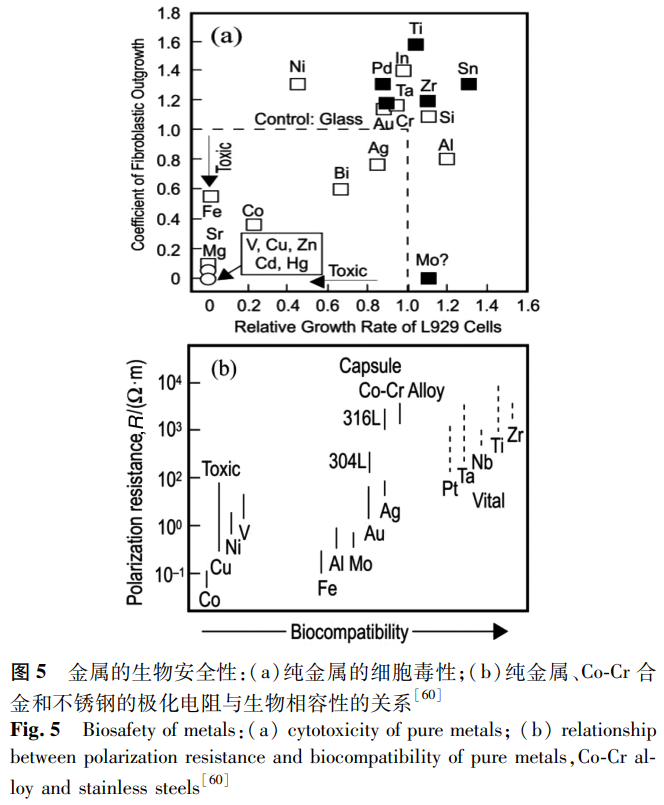
純金屬的細胞毒性以及純金屬、Co-Cr 合金和不銹鋼的極化電阻與生物相容性的關系 [60] 如圖 5 所示,可見 Zr、Nb、Ti 和 Ta 都具有良好的生物相容性。Fe 和 Mn 極易腐蝕并引起細胞毒性和基因毒性反應,人體血液中 Fe 含量升高會導致細胞損傷 [61]。Cr 具有優異的耐腐蝕性能和較低的細胞毒性,但具有強氧化性的 Cr⁶⁺會引起過敏反應,損傷人體的肝臟和腎臟,并具有致癌和遺傳毒性 [62]。Co 也被證明具有致癌和細胞毒性作用,會引起周圍組織的過敏反應和超敏反應。Ti 通常被認為是最具生物相容性的金屬之一 [63],純 Ti 具有良好的生物相容性和低的細胞毒性,這都歸功于表面 TiO₂層的形成。然而,Ti 基合金中最常見的合金元素 V 和 Al 會破壞 cp-Ti 優越的生物性能,V 被證明具有致癌作用,而 Al 雖然被證實并不是阿爾茲海默癥的原因 [64],但體內 Al 含量的增加會促進骨骼的脫礦,對腎臟有害,容易引發女性乳腺癌 [65]。Zr 和 Nb 都具有極強的生物相容性,細胞毒性低,無致癌性和突變性,耐腐蝕性好,其骨相容性甚至優于 Ti。Zhou 等 [27] 將純 Zr 和 Zr-Nb 合金置于 L-929 細胞培養基中培養 96h 后,細胞活力始終保持在 95% 以上,該合金對細胞生長和增殖幾乎無影響,具有優異的體外細胞相容性。通常認為,Ti、B、Mg、Si、P、Ca、Sr、Zr、Nb、Mo、Pd、In、Sn、Ta、Pt、Au 是生物相容性元素,Be、Al、V、Cr、Mn、Fe、Co、Ni、Cu、Zn、Ag 是有害元素 [65]。因此,在對合金設計時應選用 Nb、Ta、Ti、Mo、Sn 等無毒元素,設計出彈性模量更低、強度和耐腐蝕性更高的新型 β 型 Zr 基合金。
2.4 其他性能
對骨科植入物金屬材料來說,除上述性能外,根據植入物的不同使用功能還需要滿足一些特殊的性能要求,如抗菌性、可消毒性能與磁性能等。有數據顯示,即使經過了嚴格的無菌操作,種植修復術后口腔種植體周圍炎的患病率也可達 22%,遠高于骨折內固定術(0.4%-16%)和全關節置換術(膝蓋 0.5%-2%,髖 2%-9%,腳踝 0.3%-1.7%)后種植體周圍炎的患病率 [66]。近期發展的抗菌醫用金屬材料(Ti-Cu [67]、Ti-Zr-Cu [68]、Ti-Nb-Ag [69])主要是通過添加適量具有強抗菌功能的 Cu、Ag 等元素,在生理環境中持續、微量地釋放抗菌離子,起到廣譜、持久的抗菌作用。通過表面涂層技術將微量的 Ag、Cu、Zn 等重金屬摻入其中,從抗菌涂層中浸出的 Cu²⁺、Ag⁺或 Zn²⁺會破壞細菌的細胞壁和細胞膜,也是提高合金抗菌性能的常用途徑 [70]。植入物還應當具備可滅菌性能。通常在術前需要對植入物進行嚴格滅菌,從而避免其上攜帶的細菌等導致植入物周圍組織感染。常見的用于醫療器械的滅菌方法有熱滅菌法、化學滅菌法和輻射滅菌法三種,不過金屬材料一般都具備良好的可滅菌性能。
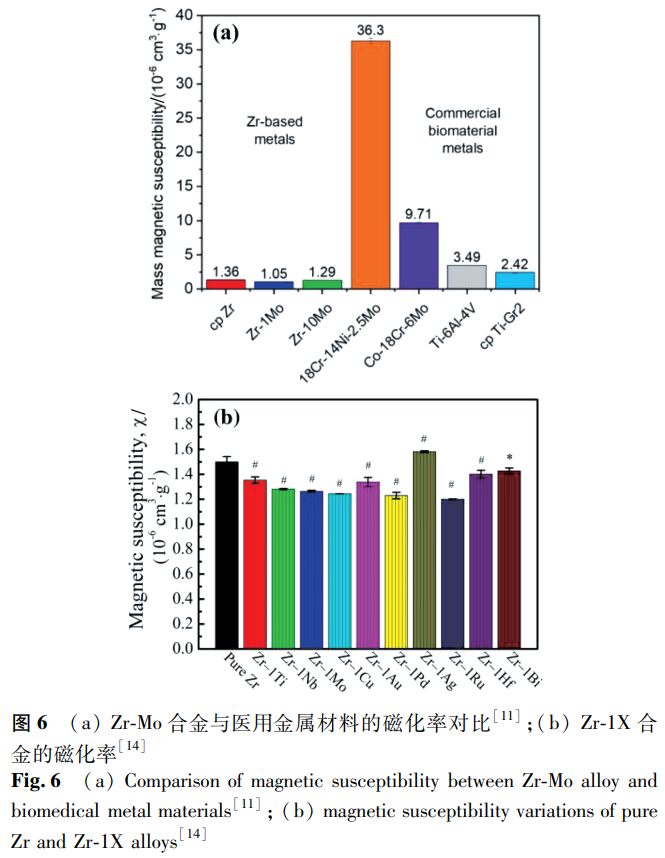
隨著 MRI 技術在骨科和腦外科診斷中的廣泛應用,醫用金屬材料的磁性能受到越來越多的關注。由高磁化率(χ)的不銹鋼、鈷鉻合金、鈦合金制成的植入物在 MRI 儀器的強磁場中會被磁化,導致植入物發熱、移位,甚至產生圖像偽影 [71]。部分 Zr 合金的磁化率如圖 6 所示。對比來看,Zr 合金的磁化率大多數低于 2.0×10⁻⁶cm³/g,明顯低于目前商用的各類醫用金屬材料,具有一定的應用前景。Zr 合金的磁化率與相組成有關,Nomura 等 [25] 研究發現 Zr-xNb 合金的磁化率低于純 Ti 和 Ti-6Al-4V 合金,相組成對磁化率的影響規律為 χ_β>χ_(α')>χ_α,在 Zr-Mo 二元合金中也發現了類似的規律 [35]。Collings 等 [72] 報道稱,磁化率取決于組成相及其體積分數,可表示為:

式中:V_α、V_β 和 V_ω 分別是 α 相、β 相和 ω 相的體積分數;χ_(α')、χ_β 和 χ_ω 是每個對應相的磁化率。
因此,通過控制合金的相組成可以起到調控合金磁化率的作用。需要注意的是 ω 相雖然具有低磁化率,但是一種硬脆相,占比過多的 ω 相會導致合金延展性變差,因此對低磁化率 Zr 合金的設計還需要綜合考慮多方面的因素。
3、醫用鋯合金的表面改性
目前,生物醫用金屬材料在應用中普遍面臨的問題是生理環境中的腐蝕所造成的金屬離子向周圍組織擴散及植入材料自身性質的退變,前者可能導致毒害作用,后者可能導致植入失效 [48]。在復雜的體液環境下,金屬材料的腐蝕和磨損是植入物失效的主要原因。據報道 [73-74],高達 80% 的關節假體返修手術都是磨損引起的植入假體松動導致的。因此,為了延長植入物壽命,采用表面改性技術改變材料表面的化學成分或組織結構以提高材料耐磨和耐腐蝕性能十分重要。目前表面改性技術已廣泛用于材料的表面處理,使醫用金屬材料得到了極大的發展。Zr 合金是很有潛力的植入物材料,但由于其硬度低、耐磨性差而在人工關節材料的應用中受到限制 [75],對其進行表面改性有利于拓展新型 Zr 基合金植入物的應用。
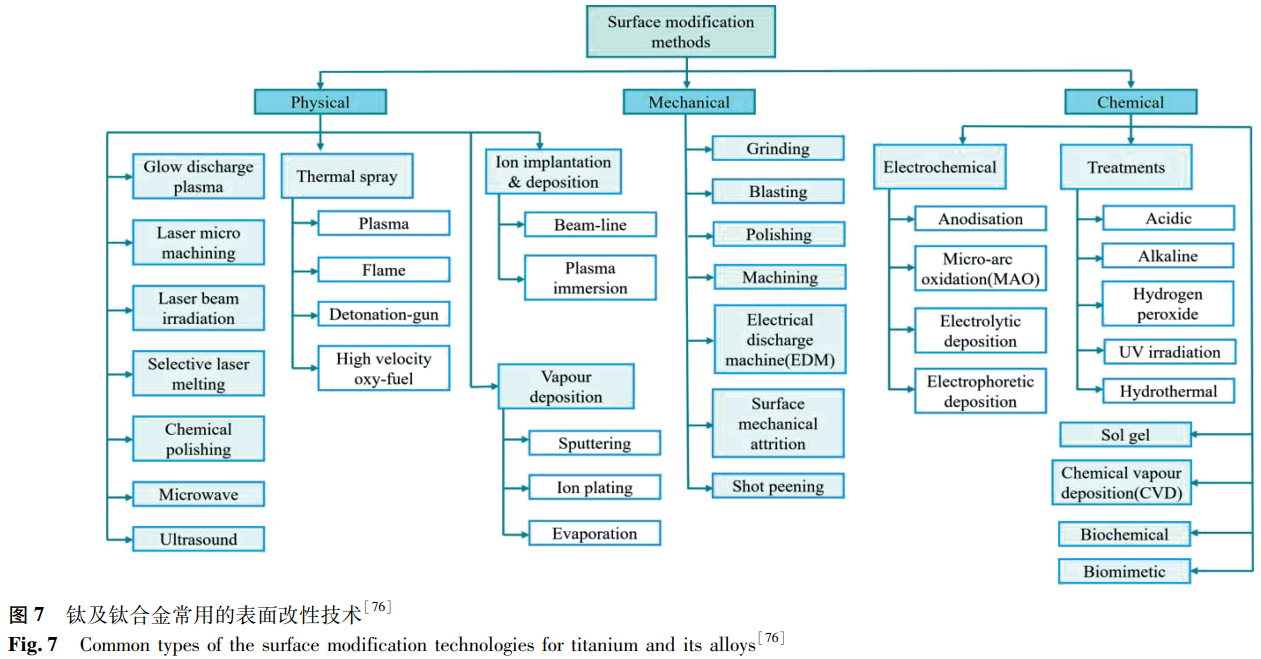
為了提高合金的表面性能,使其滿足生物醫用要求,人們開發了多種表面改性技術,主要分為物理方法、化學方法和機械方法。圖 7 [76] 給出了鈦及鈦合金常用的表面改性技術,如熱噴涂、磁控濺射、氣相沉積、離子注入等,這為 Zr 合金的表面改性研究提供了寶貴的經驗。相比之下,生物醫用 Zr 合金的表面改性研究起步較晚,但從已有的初步探索及核用 Zr 合金的經驗來看,表面處理技術對 Zr 合金的性能提升效果顯著。Liu 等 [77] 采用等離子體滲氮(PN)與激光表面織構(LST)技術相結合的方法在 Zr-2.5Nb 合金表面制備微織構氮化層,發現合金的耐磨性與 LST 和 PN 處理的順序有關,且采用 LST/PN 復合技術在 Zr-2.5Nb 合金表面制備的氮化層(Zr₃N₄和 ZrN 相)具有最高的顯微硬度和最低的磨損率。Li 等 [78] 利用陽極氧化技術在 Zr-17Nb 合金表面制備了高度有序的氧化物納米管陣列,膜層主要由正交相的 ZrO₂和 Nb₂Zr₆O₁₇組成,顯著降低了合金的楊氏模量與硬度,提高了合金的親水性,更有利于體液的浸潤。Farina 等 [79] 采用同樣的表面處理方法,比較了純 Zr 和 Zr-2.5Nb 的耐腐蝕性能,發現陽極氧化后二者均獲得了更高的耐腐蝕性能,且合金比純 Zr 表現更加優異。此外,微弧氧化 [80]、等離子體電解氧化 [81]、熱氧化 [82]、超聲沖擊強化 [83] 等技術也被證實能有效提高 Zr 合金的性能。
為了解決人工關節、牙種植體等部位面臨的磨損與腐蝕雙重問題,研究人員采用表面改性技術開發了幾種硬質涂層,如氮化鈦(TiN)、氮化鈦鈮(TiNbN)、類金剛石碳(DLC)、二氧化鈦(TiO₂)、氧化鋯(ZrO₂)和 TB-TiN 金屬基復合涂層等,這些陶瓷涂層均具有良好的體外耐磨性和生物相容性。但金屬表面硬陶瓷涂層的長期穩定性往往取決于涂層與基體的界面特性,如界面的銳度、結合強度以及涂層與基體材料的相互擴散。而原位生長的氧化物或氮化物層與基底有很強的附著力,不易發生分層或災難性斷裂,可以提供比外部沉積涂層更好的界面特性,從而確保這些耐磨涂層的長期穩定性。例如,美國 Smith and Nephew 公司在 500℃空氣中對 Zr-2.5Nb(ASTM F2384-10)合金進行熱氧化處理,制備了 5-6μm 厚的表面氧化鋯層,稱之為黑晶(Oxinium),并先后應用于全膝關節置換術(TKR)和全髖關節置換術(THR)[11,84]。與 Co-Cr 和 Ti 合金相比,該預氧化合金表面具有更高的硬度和更優良的耐磨性,在體外測試中,預氧化后的 Zr-2.5Nb 球頭比 Co-Cr 股骨頭產生的聚乙烯磨損顆粒更少 [85]。Good 和 Kim 等 [86-87] 比較了預氧化 Zr-2.5Nb 球頭和 Co-Cr 股骨頭在臨床條件下的磨損情況,發現預氧化的 Zr-2.5Nb 球頭使磨損顆粒的數量減少了 4 倍,證明預氧化 Zr-2.5Nb 球頭能有效延長臨床植入物的壽命。此外,Reger 等 [88] 對激光加工的純 Zr 進行熱氮化處理,得到 5-26μm 厚的陶瓷表面層,其由 ZrN、Zr₂N、ZrO₂和 Zr₇O₅N₄組成;熱氮化處理后的純 Zr 硬度在 492HV-1365HV,在模擬體液中對 Al₂O₃的耐磨性極大提高,比未處理的純 Zr 的體積磨損率降低了 3 個數量級,其中經 800℃/6h 的滲氮處理后,Zr 的耐腐蝕和耐磨損性能最好。Luo 等 [75] 在空氣中對 Zr-2.5Nb 合金進行熱氧化實驗,發現一定溫度和時間下的熱氧化處理提高了 Zr-2.5Nb 合金的表面硬度和耐磨性,但隨著溫度升高,氧化層(以 m-ZrO₂為主)厚度也增加,由體積膨脹引起的內應力導致了氧化層逐漸出現孔隙和裂紋。Zhou 等 [57] 對 Zr-3Sn 合金在 600℃/3h 下進行熱氧化處理,發現合金表面形成了致密的氧化層,該氧化層主要為 m-ZrO₂,使合金耐腐蝕性能與耐磨性得到提高。Zhang 等 [58] 在 600-700℃氧化處理 Zr-20Nb-Ti(x=0,3)合金,發現氧化層由大量的 m-ZrO₂、6ZrO₂-Nb₂O₅和少量的 t-ZrO₂組成,合金耐腐蝕性能與耐磨性均大幅度提高。
ZrO₂是一種生物惰性陶瓷,其生物相容性及與骨組織的結合狀況和氧化鋁(Al₂O₃)相似 [89],斷裂韌性約為 Al₂O₃陶瓷的 2 倍,斷裂強度為后者的 2-4 倍。由于具有優良的生物相容性、良好的斷裂韌性、高的斷裂強度和低的彈性模量,ZrO₂陶瓷已臨床應用于全髖置換術和全膝置換術,且在牙科領域被廣泛應用于種植體、種植基臺和全陶瓷牙冠,是主要的牙科修復體選擇之一。因此,在面對復雜的人體生理環境時,在 Zr 合金植入物表面原位生長得到的堅硬穩定的氧化鋯陶瓷具有較大的應用前景。但對 Zr 合金來說,目前通過表面改性提高合金性能并將其用于生物醫學領域的研究還較少,研發新工藝、新涂層并進一步探究植入物表面與人體細胞的相互作用是研究的新方向。即便是目前較成熟的臨床醫學植入物 —— 鈦及鈦合金,單一的涂層制備工藝也很難滿足多種醫學性能的要求,多種復合涂層制備工藝協同作用才是未來的趨勢。此外,在針對一些結構復雜的部件(如人工髖關節、膝關節)時,制備工藝的簡便性、經濟性也是大規模生產應用時需要重點考慮的問題。
新涂層的探索也很有必要,除了傳統的耐蝕耐磨涂層外,表面抗菌涂層、生物活性涂層等的研究也是拓寬 Zr 及其合金應用領域的關鍵。目前大多數抗菌涂層都是通過釋放殺菌物質來實現抗菌,并且為了避免耐藥菌株的出現,主要通過添加 Ag、Cu、Zn 等金屬元素來起到持續的殺菌效果,這在 Ti 合金表面抗菌涂層上已有大量研究,而針對 Zr 合金相關的抗菌涂層制備及抗菌性的強弱還需要大量的實驗驗證。生物活性涂層也是近年來研究的熱點,目前研究最多、應用最廣泛的生物活性涂層是羥基磷灰石(Ca₁₀(PO₄)₆(OH)₂,HA)及其復合涂層 [90]。羥基磷灰石是人體和動物骨骼的主要無機成分,具有良好的生物相容性、骨傳導性以及骨誘導性,能夠與骨組織緊密結合且會逐漸降解產生 Ca²⁺和 PO₄³⁻,最后被人體吸收利用長出新的骨組織 [91]。Singh 等 [92] 采用等離子噴涂在 β 相 Ti-35Nb-7Ta-5Zr 髖關節假體合金上沉積一層致密無裂紋的 HA-TiO₂涂層,增強了合金耐腐蝕性能和生物活性,涂層表面形成磷灰石,促進了合金與骨組織的化學整合。Rafieerad 等 [93] 采用電泳沉積法在 Ti-6Al-7Nb 合金表面制備了 HA-ZrO₂復合涂層,該涂層表現出超親水性,且在培養 5d 后誘導了模擬體液中磷灰石的生成,提高了細胞相容性。雖然涂層的生物活性得到顯著提高,但是涂層與基材熱膨脹系數的差異會導致較大的殘余應力,限制界面結合強度,同時涂層的生物活性與穩定性往往此消彼長,如何制得致密無裂紋、厚度均勻、與基體結合力強的 HA 涂層及 HA 復合涂層仍具有一定的挑戰性。總的來說,Zr 合金及其表面涂層的研究起步較晚,但通過借鑒目前已商用 Ti 合金的成熟經驗,設計出合理的多功能涂層,有希望在現有研究的基礎上實現新的跨越,獲得性能優異的醫用 Zr 合金。
4、結語與展望
Zr 合金可以滿足新型骨科植入物材料大部分的性能要求,包括生物相容性、強度、延展性、模量、耐腐蝕性能和耐磨性,且適用于 MRI 診斷,將有廣闊的應用前景。目前,大部分研究主要通過改變合金成分和制備加工方法來得到不同的相組成,從而調控合金的性能,研究的方向逐漸從以 Zr-Nb、Zr-Mo 和 Zr-Ti 系為主的二元合金走向多元合金,從關注材料單一的低模量到考慮合金適配的力學性能、耐腐蝕性能與生物相容性協同發展。此外,為了縮短合金的研發周期,結合 d 電子理論、價電子濃度等合金設計理論和第一性原理計算與有限元分析方法可以為新型 Zr 合金體系的開發和工藝加工提供理論指導。在器件制備方面,3D 打印技術逐漸成為當前的熱點,它可以針對不同患者的需求及醫療器件的結構復雜性進行定制化打印,效率高且具有高度的靈活性,將成為醫用植入物金屬材料的一個重要發展方向。
采用表面改性技術制備耐蝕耐磨涂層、生物活性涂層和表面抗菌涂層能夠有效拓寬醫用 Zr 合金的應用領域。通過借鑒醫用 Ti 合金的經驗可以幫助 Zr 合金實現表面改性技術的快速應用,且隨著表面涂層的研究逐漸由單一膜層朝著多組元、多層復合涂層發展,采用新的表面改性技術及多種技術的復合來得到性能優異的多功能涂層是未來的重要發展趨勢之一。在此基礎上,在研究材料表面抗菌性、建立 Zr 合金表面生物活性評價體系、解決涂層與基體的界面穩定性的同時,進一步改善合金表面的生物性與生物力學性能,是未來 Zr 及其合金表面功能涂層研究的重要方向。
參考文獻
[1] Li C L, Zhan Y Z, Jiang W P. Materials & Design, 2011, 32, 4598.
[2] Sumita M, Hanawa T, Ohnishi I, et al. Comprehensive Structural Integrity, 2003, 4, 131.
[3] Wang C T, Ge S R, Jin Z M. The engineering of orthopedic implants, Shanghai Jiao Tong University Press, China, 2016, pp. 355 (in Chinese).
王成燾,葛世榮,靳忠民。骨科植入物工程學,上海交通大學出版社,2016, pp. 355.
[4] Ren J S, Zhang Y M, Tan J, et al. Materials Reports, 2016, 30 (S2), 384 (in Chinese).
任軍帥,張英明,譚江,等。材料導報,2016, 30 (S2), 384.
[5] Wei C X, Luo L Y, Wu Z X, et al. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 111, 104017.
[6] Okazaki Y, Sethumadhvan R, Yoshimasa I, et al. Biomaterials, 1998, 19 (13), 1197.
[7] Lopez M F, Jimenez J A, Gutierrez A. Electrochimica Acta, 2003, 48 (10), 1395.
[8] Sumner D R, Turner T M, Igloria R, et al. Journal of Biomechanics, 1998, 31, 909.
[9] Geetha M, Singh A K, Asokamani R, et al. Progress in Materials Science, 2009, 54, 397.
[10] Okazaki Y. Biomaterials, 2002, 23, 2071.
[11] Suzuki A K, Campo K N, Fonseca E B, et al. Scientific Reports, 2020, 10, 2621.
[12] Yoshiaki I, Kazuhiro T, Equo K, et al. Materials Transactions, 2005, 46, 2260.
[13] Hobbs L W, Rosen V B, Mangin S P, et al. International Journal of Applied Ceramic Technology, 2005, 2 (3), 221.
[14] Zhou F Y, Qiu K J, Li H F, et al. Acta Biomaterialia, 2013, 9 (12), 9578.
[15] Liu J Z. Nuclear structural materials, Chemical Industry Press, China, 2007, pp. 192 (in Chinese).
劉建章。核結構材料,化學工業出版社,2007, pp. 192.
[16] Kobayashi E, Doi H, Yoneyama T, et al. Journal of the Japanese Society for Dental Materials and Devices, 1995, 14 (3), 321.
[17] Zhang Y M, Guo T W, Li Z C. West China Journal of Stomatology, 1999, 17 (4), 329 (in Chinese).
張玉梅,郭天文,李佐臣。華西口腔醫學雜志,1999, 17 (4), 329.
[18] Grandin H M, Berner S, Dard M. Materials, 2012, 5 (8), 1348.
[19] Al-Nawas B, Bragger U, Meijer H J, et al. Clinical Implant Dentistry and Related Research, 2012, 14 (6), 896.
[20] Barter S, Stone P, Bragger U. Clinical Oral Implants Research, 2012, 23, 873.
[21] Chiapasco M, Casentini P, Zaniboni M, et al. Clinical Oral Implants Research, 2012, 23 (10), 1136.
[22] Guglielmotti M B, Renou S J, Cabrini R L. International Journal of Oral & Maxillofacial Implants, 1999, 14 (4), 565.
[23] Tsutsumi Y, Nishimura D, Doi H, et al. Materials Science & Engineering C, 2009, 29 (5), 1702.
[24] Branzoi I V, Iordoc M, Branzoi F. Key Engineering Materials, 2009, 415, 13.
[25] Nomura N, Tanaka Y, Suyalatu, et al. Materials Transactions, 2009, 50 (10), 2466.
[26] Kondo R, Nomura N, Suyalatu, et al. Acta Biomaterialia, 2011, 7, 4278.
[27] Zhou F Y, Wang B L, Qiu K J, et al. Materials Science & Engineering C, 2012, 32, 851.
[28] Kondo R, Shimizu R, Naoyuki N, et al. Acta Biomaterialia, 2013, 9, 5795.
[29] Zhao X L, Li L, Niinomi M, et al. Acta Biomaterialia, 2017, 62, 372.
[30] Nie L, Zhan Y Z, Hu T, et al. Journal of the Mechanical Behavior of Biomedical Materials, 2014, 29, 1.
[31] Xue R H, Wang D, Yang D W, et al. Materials, 2013, 13, 5130.
[32] Wang M K, Yuan J H, Liu Y F, et al. Acta Metallurgica Sinica, 2021, 57 (1), 95 (in Chinese).
王明康,苑峻豪,劉宇峰,等。金屬學報,2021, 57 (1), 95.
[33] Rosalbino F, Maccio D, Giannoni P, et al. Journal of Materials Science: Materials in Medicine, 2011, 22, 1293.
[34] Liang J S, Liu L B, Xu G L, et al. Calphad, 2017, 56, 196.
[35] Suyalatu, Nomura N, Oya K, et al. Acta Biomaterialia, 2010, 6 (3), 1033.
[36] Suyalatu, Kondo R, Tsutsumi Y, et al. Acta Biomaterialia, 2011, 7, 4259.
[37] Zhou F Y, Wang B L, Qiu K J, et al. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2013, 101B (2), 237.
[38] Nie L, Zhan Y Z, Liu H, et al. Materials & Design, 2014, 53, 8.
[39] Guo S, Shang Y, Zhang J S, et al. Journal of Alloys and Compounds, 2018, 754, 232.
[40] Hsu H C, Wu S C, Sung Y C, et al. Journal of Alloys and Compounds, 2009, 488, 279.
[41] Wei C X, Luo L Y, Wu Z X, et al. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 111, 104017.
[42] Wang D, Liu L B, Xue R H. Materials Science and Engineering of Powder, 2021, 26 (2), 125 (in Chinese).
王東,劉立斌,薛人豪,等。粉末冶金材料科學與工程,2021, 26 (2), 125.
[43] Kim T I, Han J H, Lee I S, et al. Bio-medical Materials and Engineering, 1997, 7 (4), 253.
[44] Shibutani H, Morinaga M, Kikuchi K. Atomic Energy Society of Japan, 1998, 40 (1), 70.
[45] Afrin M, Song T, Wei X, et al. Advanced Engineering Materials, 2018, 20 (9), 1800207.
[46] Bachtar F, Chen X, Hisada T. Medical & Biological Engineering & Computing, 2006, 44, 643.
[47] Frost H M. The Angle Orthodontist, 2004, 74 (1), 3.
[48] Lyu J, Cheng J, Hou X B. Introduction to biomaterials, Tongji University Press, China, 2016, pp. 23 (in Chinese).
呂杰,程靜,侯曉蓓。生物醫用材料導論,同濟大學出版社,2016, pp. 23.
[49] Kuncicka L, Kocich R, Lowe T C. Progress in Materials Science, 2017, 88, 232.
[50] Kim M, An S, Huh C, et al. Applied Sciences, 2019, 9, 5281.
[51] Chui P F. Vacuum, 2017, 143, 54.
[52] Zhou F Y, Qiu K J, Bian D, et al. Journal of Materials Science & Technology, 2014, 30 (4), 299.
[53] Nie L, Zhan Y Z, Liu H, et al. Materials Science & Engineering C, 2013, 33, 5105.
[54] Guo S, Zhang J M, Shang Y, et al. Journal of Alloys and Compounds, 2018, 745, 234.
[55] Xue G L, Yang H L, Xing H X, et al. Journal of Central South University, 2020, 27, 2185.
[56] Gu Q S, Hou C L, Xu Z. Practical biomedical materials science, Shanghai Science and Technology Press, China, 2005, pp. 182 (in Chinese).
顧其勝,侯春林,徐政。實用生物醫用材料學,上海科學技術出版社,2005, pp. 182.
[57] Zhou F Y, Wang B L, Qiu K J, et al. Applied Surface Science, 2013, 265, 878.
[58] Zhang J F, Gan X X, Tang H Q, et al. Materials Science & Engineering C, 2017, 76, 260.
[59] Liu D Y, Zhan Y Z. Guangxi Sciences, 2018, 25 (6), 633 (in Chinese).
劉東云,湛永鐘。廣西科學,2018, 25 (6), 633.
[60] Niinomi M. The Journal of the Minerals, Metals & Materials Society, 1989, 51 (6), 32.
[61] Biesiekierski A, Wang J, Gepreel M, et al. Acta Biomaterialia, 2012, 8, 1661.
[62] Chen Q Z, Thouas G A. Materials Science & Engineering R-Reports, 2015, 87, 1.
[63] Oldani C, Dominguez A. Recent Advances in Arthroplasty, 2012, 218, 149.
[64] Niinomi M, Nakai M, Hieda J. Acta Biomaterialia, 2012, 8 (11), 3888.
[65] Calin M, Gebert A, Ghinea A C, et al. Materials Science & Engineering C, 2013, 33, 875.
[66] Zhang E L, Zhao X T, Hu J L, et al. Bioactive Materials, 2021, 6 (8), 2569.
[67] Mahmoudi P, Akbarpour M R, Lakeh H B, et al. Materials Today Bio, 2022, 17, 100447.
[68] Yu J Y, Yang X X, Zhan D S, et al. Chinese Journal of Materials Research, 2021, 35 (11), 873 (in Chinese).
于佳瑩,楊希祥,戰德松,等。材料研究學報,2021, 35 (11), 873.
[69] Taipina M O, Mello M G, Tamborlin L, et al. Materials Chemistry and Physics, 2021, 261, 124192.
[70] Fu S, Zhang Y, Yang Y, et al. Journal of Materials Science & Technology, 2022, 119, 75.
[71] Bui F M, Bott K, Mintchev M P. Journal of Medical Engineering & Technology, 2000, 24 (1), 20.
[72] Collings E W. Metallurgical and Materials Transactions A, 1979, 10A, 463.
[73] Mattei L, Di Puccio F, Piccigallo B, et al. Tribology International, 2011, 44, 532.
[74] Gremillard L, Martin L, Zych L, et al. Acta Biomaterialia, 2013, 9, 7545.
[75] Luo Y, Yang T, Rao X, et al. International Journal of Advanced Manufacturing Technology, 2018, 96, 1539.
[76] Alipal J, Mohd P N, Nayan N, et al. Materials Today: Proceedings, 2021, 42 (1), 270.
[77] Liu Y Y, Yang Y L, Dong D Y, et al. Journal of Engineering, 2020, 20, 100638.
[78] Li L, Yao S L, Zhao X L, et al. Acta Metallurgica Sinica, 2019, 55 (8), 1008 (in Chinese).
李玲,姚生蓮,趙曉麗,等。金屬學報,2019, 55 (8), 1008.
[79] Farina S B, Sanchez A G, Cere S. Procedia Materials Science, 2015, 8, 1166.
[80] Wang S, Guo F, Bai H R, et al. Rare Metal Materials and Engineering, 2010, 39 (4), 739 (in Chinese).
王雙,郭鋒,白海瑞,等。稀有金屬材料與工程,2010, 39 (4), 739.
[81] Chen Y, Nie X, Northwood D O. Surface & Coatings Technology, 2010, 205 (6), 1774.
[82] Reger N C, Balla V K, Das M, et al. Surface & Coatings Technology, 2018, 334, 357.
[83] Mordyuk B N, Karasevskaya O P, Prokopenko G I. Materials Science & Engineering A, 2013, 559, 453.
[84] Ratner B D, Hoffman A S, Schoen F J, et al. Biomaterials science: an introduction to materials in medicine, Elsevier Press, Netherlands, 2004, pp. 537.
[85] Good V, Ries M, Barrack R L, et al. Journal of Bone & Joint Surgery, 2003, 85, 105.
[86] Good V, Widding K, Hunter G, et al. Materials in Engineering, 2005, 26 (7), 618.
[87] Kim Y H. Journal of Bone & Joint Surgery, 2005, 87 (8), 1769.
[88] Reger N C, Vamsi K B, Mitun D, et al. Surface & Coatings Technology, 2018, 334, 357.
[89] Brunski J B. Clinical Materials, 1992, 10, 153.
[90] Bai X H, Fan L, Zhao M Y, et al. Titanium Industry Progress, 2022, 39 (3), 33 (in Chinese).
白雪寒,范林,趙銘鈺,等。鈦工業進展,2022, 39 (3), 33.
[91] Hsu H C, Wu S C, Yang C H, et al. Journal of Materials Science: Materials in Medicine, 2009, 20, 615.
[92] Singh S, Prakash C, Singh H. Surface & Coatings Technology, 2020, 398, 126072.
[93] Rafieerad A R, Bushroa A R, Nasiri-Tabrizi B, et al. Advances in Applied Ceramics, 2017, 116 (6), 293.
tag標簽:醫用鋯基合金



